Durante
el siglo
XVII los
fisicos
consideraban que el calor
era un fluido
invisible sin sabor, olor
o
color.
Lo
cual
era erroneo
por
la razon
de que no podia ser creado
o destruido,
razon
por
la cual
no era posible
formarlo
apartir
de alguna
cosa.

—El
calor
es
la magnitud
fisica
o parametro
que describe las interacciones
de un sistema
con otro
dado que corresponde a
la cantidad
de energia
que se transfiere
de un sistema
a otro.
—El
calor
se trasmite
de un cuerpo
caliente a uno
frio
hasta
que se encuentra
un equilibrio
de temperaturas.—Se
mide
con joules o calorias
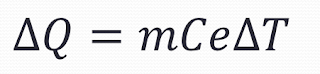 |
M= masa
Ce= Calor especifico
CALOR ESPECIFICO
Se
define como
la cantidad
de calor
(Q), que se debe sumistrar
a la masa de un cuerpo
para elevar
su
temperatura
en
un grado
centigrado.
Algunos materiales ya se sabe ese calor que esta en una tabla como lo siguientes:
CANTIDAD DE CALOR
Problemas a resolver
TEMA 2
PROCESOS TERMODINÁMICOS
Se denomina proceso termodinámico a la evolución de determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a un determinado sistema termodinámico. Primera ley de la termodinamica
›La
primera ley de la termodinámica establece que, cuando se añade
calor Q a
un sistema mientras éste efectúa trabajo W, la
energía interna U cambia
en una cantidad igual a Q
– W.
›La
primera ley de termodinámica es la misma ley del principio de conservación de
la energía, la cual exige que para todo sistema termodinámico se cumpla:
›∆U = Q-W
Siendo ∆U la
energía interna del sistemaLeyes de gases
1 atm = 101325 Pa
2
1 atm = 1,01325 bar
1 atm = 760 mmHg
= 760 Torr
1 atm = 10,332274527999 m.c.a.
(metros de columna de agua)
1 atm = 14,69594877551 PSI
(libra por pulgada cuadrada)
Proceso
adiabático
›Se
designa como proceso adiabático a aquel en el cual el
sistema (generalmente, un fluido que realiza un trabajo) no
intercambia calor con su entorno.
›Durante
un
proceso adiabático, la energía interna del fluido que realiza el trabajo debe
necesariamente decrecer.
›Es
decir, que en este tipo de procesos se tiene que Q = 0. Que
de acuerdo con la primera ley de la termodinámica, tenemos que:
›Q= ∆U
+W
›Como
Q
=0,
entonces,∆U = -W.
Proceso
isotérmico
›En
este proceso la temperatura permanece constante. Como la energía interna de una
gas ideal sólo es función de la temperatura, en un proceso isotérmico de un gas
ideal la variación de la energía interna es cero (∆U= 0) La curva hiperbólica se
conoce como isotérmica.
›De
acuerdo con la primera ley de la termodinámica tenemos:
›Q = ∆U +W.
›Como ∆U = 0,
entonces, Q = W
›Estos
son los procesos en los cuales antes, durante
y después la temperatura es constante.
Proceso
isobárico
Se efectúa a presión constante. En
general, ninguna de las tres cantidades:
es cero en un
proceso isobárico, pero aun así es fácil calcular W.
›Es
un proceso termodinámico en el cual la presión permanece constante, en este
proceso, como la presión se mantiene constante, se produce una variación en el
volumen y por tanto el sistema realiza trabajo.
›De
acuerdo
con la primera ley de la termodinámica, tenemos:
› Q = ∆U +W
›Lo
que quiere decir que en un proceso de tipo isobárico tanto el calor transferido
como el trabajo realizado ocasionan una variación de la energía interna.
›Procesos
en
los cuales antes,
durante
y después
la
presión
es
constante.
Proceso
isométrico
›En
este proceso el volumen permanece constante, es decir que en este tipo de
proceso el volumen no varía y por tanto el trabajo es igual a cero, lo que
significa que W= 0.
›De
acuerdo con la primera ley de la termodinámica tenemos:
›Q = ∆U +W
›Como
W=0,
entonces Q = ∆U
›El
volumen es constante antes, durante
y después.
TRANSMISIÓN DE CALOR
El calor se transmite de un lugar a otro de tres maneras diferentes: Por conducción entre cuerpo sólidos en contacto. Por convección en fluidos (líquidos o gases). Radiación (en gases).
La transferencia de calor es el proceso de propagación del calor en
distintos medios. La transferencia de calor se produce siempre cuando dos sistemas con diferentes
temperaturas se ponen en contacto. El proceso persiste hasta alcanzar el
equilibrio térmico, es decir, hasta que se igualan las temperaturas.
CONDUCCIÓN
Consiste en la transferencia de calor entre dos puntos de un cuerpo que se encuentran a diferente temperatura sin que se produzca transferencia de materia entre ellos.
RADIACIÓN
Es el calor emitido por un cuerpo debido a su temperatura, en este caso no existe contacto entre los cuerpos, ni fluidos intermedios que transporten el calor. Simplemente por existir un cuerpo A (sólido o líquido) a una temperatura mayor que un cuerpo B existirá una transferencia de calor por radiación de A a B.
Para que este fenómeno se perciba es necesario un cuerpo a una temperatura bastante elevada
CONVECCIÓN
En este sistema de transferencia de calor
interviene un fluido (gas o líquido) en movimiento que transporta la energía
térmica entre dos zonas.
La transmisión de calor por
convección puede ser:
•Forzada:
a través de un ventilador (aire) o bomba (agua) se mueve el fluido a través de
una zona caliente y éste transporta el calor hacía la zona fría.
•Natural:
el propio fluido extrae calor de la zona caliente y cambia su densidad haciendo
que se desplace hacía la zona más fría donde cede su calor.
CAMBIOS DE ESTADO DE MATERIA
Cuando un cuerpo, por acción del calor o del frío pasa de un estado a otro, decimos que ha cambiado de estado. En física y química se define cambio de estado como la evolución de la materia entre varios estados de agregación sin que ocurra un cambio en su composición. Por ejemplo, en el caso del agua, cuando hace calor, el hielo (agua en estado sólido) se derrite y si calentamos agua líquida vemos que se evapora. El resto de las sustancias también puede cambiar de estado si se modifican las condiciones en que se encuentran. Además de la temperatura, también la presión influye en el estado en que se encuentran las sustancias. Los cambios que se presentan en la materia son: fusión, vaporización, cristalización, solidificación, sublimación y condensación.
Fusión:
Si se calienta un sólido, llega un momento en que se transforma en líquido. Este proceso recibe el nombre de fusión. El punto de fusión es la temperatura que debe alcanzar una sustancia sólida para fundirse. Cada sustancia posee un punto de fusión característico. Por ejemplo, el punto de fusión del agua pura es 0 °C a la presión atmosférica normal.
Vaporización:
Si calentamos un líquido, se transforma en gas. Este proceso recibe el nombre de vaporización o evaporación. Cuando la vaporización tiene lugar en toda la masa de líquido, formándose burbujas de vapor en su interior, se denomina ebullición. También la temperatura de ebullición es característica de cada sustancia y se denomina punto de ebullición. El punto de ebullición del agua es 100 °C a la presión atmosférica normal.
Cristalización:
La cristalización o sublimación inversa (regresiva) es el cambio de la materia del estado gaseoso al estado sólido de manera directa, es decir, sin pasar por el estado líquido.
Solidificación:
En la solidificación se produce el cambio de estado de la materia de líquido a sólido, debido a una disminución en la temperatura. Este proceso es inverso a la fusión. El mejor ejemplo de este cambio es cuando metes al congelador un vaso de agua. Al dejarlo por unas horas ahí el agua se transforma en hielo (líquido a sólido), debido a la baja temperatura.
Sublimación:
La sublimación o volatilización, es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Al proceso inverso se le denomina sublimación inversa; es decir, el paso directo del estado gaseoso al estado sólido. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco.
Condensación:
La condensación, es el cambio de estado que se produce en una sustancia al pasar del estado gaseoso al estado líquido. La temperatura a la que ocurre esta transformación se llama punto de condensación.
EQULIBRIO TERMICO
El equilibrio térmico es aquel estado en el cual se igualan las temperaturas de dos cuerpos, las cuales, en sus condiciones iniciales presentaban diferentes temperaturas, una vez que las temperaturas se equiparan se suspende el flujo de calor, llegando ambos cuerpos al mencionado equilibrio térmico
Es el estado en el que se igualan las temperaturas de dos cuerpos que inicialmente tenían diferentes temperaturas. Al igualarse las temperaturas se suspende el flujo de calor , y el sistema formados por esos cuerpos llega a su equilibrio térmico .
Por ejemplo, si pone tienes un recipiente con agua caliente, y otro con agua fría, a través de sus paredes se establecera un flujo de energía calorífica , pasado un tiempo, la temperatura del agua en ambos recipientes se igualará (por obra de las transferencias de calor , en este caso del agua más caliente a la más fría, también por contacto con el aire del medio ambiente y por evaporación), pero el equilibrio térmico lo alcanzarán cuando ambas masas de agua estén a la misma temperatura.
ENERGIA INTERNA
La magnitud que designa la energía almacenada por un sistema de partículas se denomina energía interna (U). La energía interna es el resultado de la contribución de la energía cinética de las moléculas o átomos que lo constituyen, de sus energías de rotación, traslación y vibración, además de la energía potencial intermolecular
Energía interna de un gas ideal
Para el caso de un gas ideal puede demostrarse que la energía interna depende exclusivamente de la temperatura, ya en un gas ideal se desprecia toda interacción entre las moléculas o átomos que lo constituyen, por lo que la energía interna es sólo energía cinética, que depende sólo de la temperatura. Este hecho se conoce como la ley de Joule.
La variación de energía interna de un gas ideal (monoatómico o diatómico) entre dos estados A y B se calcula mediante la expresión
donde n es el número de moles y Cv la capacidad calorífica molar a volumen constante. Las temperaturas deben ir expresadas en Kelvin.
Para demostrar esta expresión imaginemos dos isotermas caracterizadas por sus temperaturas TA y TB
Un gas ideal sufrirá la misma variación de energía interna (ΔUAB) siempre que su temperatura inicial sea TA y su temperatura final TB, según la Ley de Joule, sea cual sea el tipo de proceso realizado.




























